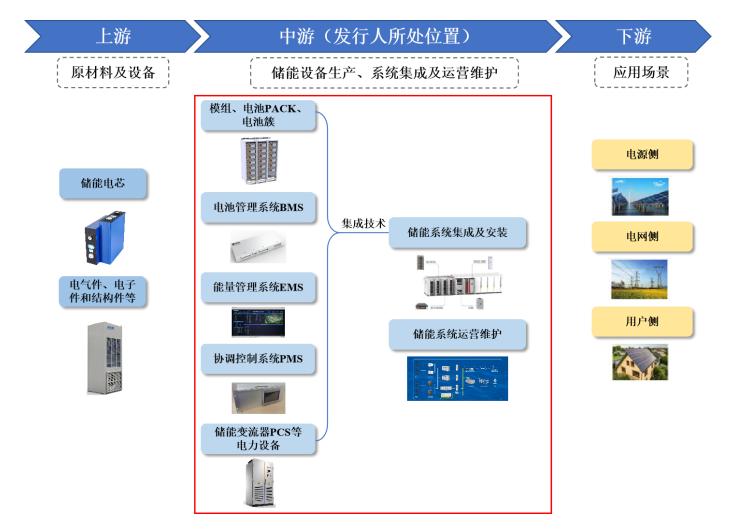
10月17日晚间,博瑞医药发布公告称,公司董事长袁建栋于近日收到中国证券监督管理委员会江苏监管局下达的《江苏证监局关于对袁建栋采取出具警示函措施的决定》。
警示函表示,经查,袁建栋作为博瑞医药董事长、总经理,在2023年10月12日下午召开的“大咖解读GLP-1全产业链系列交流会”电话会议上发布了个人试用公司在研产品BGM0504注射液相关情况。
据媒体报道,在10月12日公司投资者电话会议上,博瑞医药董事长袁建栋在谈及公司研发的、降糖减重药(BGM0504注射液)时称,自己尝试之后,两个月从91公斤就降到了76公斤。
目前BGM0504注射液用于减重尚处于临床试验阶段,有效性尚不明确,袁建栋关于药效的相关言论具有误导性,违反了《上市公司信息披露管理办法》(证监会令第182号)第四十九条第二款的规定。江苏证监局决定对袁建栋采取出具警示函的行政监管措施,并记入证券期货市场诚信档案。
博瑞医药表示,在警示函所述事项发生后,公司于2023年10月14日及时披露《股票交易风险提示公告》。公司相关人员高度重视警示函中指出的问题,将认真吸取教训,杜绝此类违规行为再次发生。
受此影响,博瑞医药股价10月18日收盘41.79元,跌幅2.99%,而此前10月12日公布董事长“瘦身成功”消息时,股价曾在开盘时涨停,涨幅20%,并在此后两日连续上涨,涨幅分别为9.14%和5.77%。
药物仍处于II期临床
博瑞医药的BGM0504注射液是一款GLP-1和GIP受体双重激动剂,拟用于开展治疗2-型糖尿病及超重或肥胖症的临床试验。
目前,博瑞医药拥有原料药与制剂一体、仿创结合业务。多肽类降糖药BGM0504注射液所属博瑞医药创新药物研发领域。
博瑞医药曾在公告中表示,公司控股子公司博瑞新创生物医药科技(无锡)有限公司自主研发的多肽类降糖药BGM0504注射液,尚处于研发阶段。截至公告披露,减重和2型糖尿病治疗两项适应症均仅获得II期临床试验伦理批件,其中2型糖尿病治疗的II期临床已开始入组。待II期临床试验完成后,尚需经国家药监局确认确证性临床试验方案,开展并完成III期临床研究,并经国家药监局审评、审批通过后方可生产上市。
这代表着BGM0504注射液目前仅处于II期临床入组阶段,而每种药物上市前,都需要经历候选药物研发、临床前研究、临床试验(Ⅰ期、Ⅱ期、Ⅲ期)、新药申请、批准上市和上市后监测(Ⅳ期临床试验)等步骤。
同时,行业内众所周知,药品的研发周期普遍较长,各项临床研究的入组及研究方案实施等受到多种不确定因素影响,临床研究存在结果不及预期甚至临床研究失败的风险。对博瑞医药来说,将仅仅处于II期临床试验的药物私自使用以及向市场宣传,都是违反流程的。
除董事长亲自下场带货外,还有没提报道称其将未上市药物赠送给了其他企业老板。向一般公众赠送尚处于临床试验的药物涉嫌违反我国的药品管理制度。
实际上,这并非博瑞医药首次收到警示函。2020年初,博瑞医药在新冠疫情期间曾发布公告称,公司“于近日成功仿制开发了瑞德西韦原料药合成工艺技术和制剂技术。公司已经批量生产出瑞德西韦原料药,瑞德西韦制剂批量化生产正在进行中”。
后经江苏证监局核查,博瑞医药所称“批量生产”实际为药品研发中小试、中试等批次的试验性生产,而非已完成审批并开始正式规模化、商业化生产销售瑞德西韦原料药和制剂。最终,因信息披露不准确,违反相关规定,江苏证监局对博瑞医药及董事会秘书王征野采取出具警示函的行政监管措施,并记入证券期货市场诚信档案。
2022年年报显示,公司实现营业收入10.17亿元,同比减少3.33%;归属于上市公司股东的净利润2.40亿元,同比减少1.77%。
2023年半年报显示,2023年1-6月,公司实现营业收入5.87亿元,同比增长17.41%;归属于上市公司股东的净利润1.09亿元,同比减少2.29%。报告期内,公司原料药产品收入4.42亿元,较上年同期增长12.44%。其中,抗病毒类产品收入较去年增长185.38%,主要系客户对奥司他韦原料药需求增加影响;抗真菌类产品收入较去年减少37.23%;免疫抑制类产品收入减少20.55%。原料药收入增长主要依靠抗病毒类产品,其中奥司他韦占比较大。
火热的减肥药市场
随着GLP-1减肥效果的公布,这类药物便成为了如今最炙手可热的靶点药物。
GLP-1是一种主要由肠道L细胞所产生的激素,广泛存在分布于全身多个器官和组织,可以促进人体胰岛素的分泌,起到降低血糖的功效。血糖降低让人容易产生饱腹感,也就变相达到了减肥的效果。
2014年,诺和诺德在全球首先开发出第一代GLP-1类似物利拉鲁肽,用于减肥的适应症。在这之后,GLP-1的“斗争”便不断升温。诺和诺德开发的利拉鲁肽从一种降血糖药物成功转型为减肥药。根据诺和诺德的Ⅲ期临床试验数据显示,在坚持使用56周之后,约62%的肥胖患者体重下降了5%,34%的患者体重下降幅度达到10%。
GLP-1带来的销售,也是让如今多家厂商趋之若鹜的主要原因。2023年上半年Wegovy®(司美格鲁肽注射液,减重适应症)实现收入120.81亿丹麦克朗(17.3亿美元),同比增长367%;根据诺和诺德公告,Wegovy®上半年在美国地区周处方量迅速增长,截至2023年7月周处方量约9.4万。
市场的火热也将GLP-1的这股风刮到了国内。目前在我国获批临床试验用于肥胖治疗的药物共有23个。包括生物制品11个、化药10个、中药2个。生物制品包括司美格鲁肽注射液、利拉鲁肽注射液等。九源基因、华东医药(000963)、丽珠集团(000513)、联邦制药等多家企业瞄准了司美格鲁肽这一赛道。其中,九源基因研发的司美格鲁肽注射液已进入III期临床试验。

而利拉鲁肽的研发也有众多入局者。诺和诺德利拉鲁肽在中国已过专利保护期,华东医药、万邦医药、爱美客等多家药企布局研发用于治疗成人超重/肥胖的利拉鲁肽,其中远大医药及华东医药、通化东宝(600867)、翰宇药业(300199)的利拉鲁肽已经申请上市。
如今GLP-1药物已经成了股价密码,相关企业在年内多次股票迎来涨幅,其中常山药业(300255)自8月31日官宣艾本那肽药物已经完成3期临床试验开始,股价便一路狂奔,从9月1日至9月26日累计涨幅高达99.95%,同期市值暴增65.63亿元。
资本市场对GLP-1的追捧,也让越来越多的国内药企试图“分一杯羹”,但也有不少企业因为炒作这一概念而收到监管函。面对这一“野蛮生长”的赛道,各家究竟实力如何,仍需实打实的上市药物来佐证。